👉
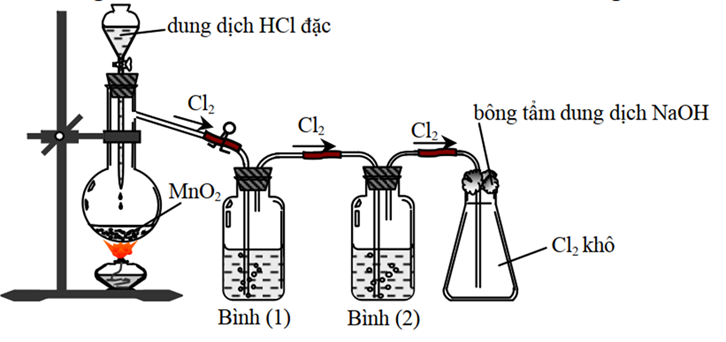
Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl:
Khí Cl2 sinh ra thường lẫn hơi nước và hydrogen Chloride. Để thu được khí Cl2 khô thì bình (1) và bình (2) lần lượt đựng
A. Dung dịch NaCl và dung dịch H2SO4 đặc.
B. Dung dịch H2SO4 đặc và dung dịch NaCl.
C. Dung dịch H2SO4 đặc và dung dịch AgNO3.
D. Dung dịch NaOH và dung dịch H2SO4 đặc.
🔥 Đây là câu trắc nghiệm phân loại trong Đề thi Đại học năm 2014 (môn Hóa, khối B). Rất nhiều học sinh làm sai câu này. Mời các bạn thử sức!
👉 Đừng quên:
✍️ Comment đáp án của bạn nhé! (+ gắn thẻ bạn bè vào để “thách đố họ”)
👍 Like nếu thấy nội dung / video hữu ích.
🔁 Share để bạn bè cùng thử sức. 🎯 Hướng dẫn giải, đáp án ở bình luận/YouTube @GiaSuDucToai
#HóaHọc10 #HóaTHPT #OnThiTHPT #THPT #DanhGiaNangLuc #GiaSuDucToai

1 bình luận
GỢI Ý GIẢI – ôn tập, củng cố kiến thức
Đáp án A (hình SGK lớp 10): Bình 1: dung dịch NaCl giữ lại khí HCl, bình 2 dung dịch H₂SO₄ đặc hấp thu hơi nước (bông tẩm dung dịch NaOH để hấp thu khí HCl chưa được hấp thu hết). Bình 1 dùng dung dịch NaCl vì nồng độ ion Cl- trong dung dịch có tác dụng giảm được khí Chlorine hòa tan vào nước, tác dụng với nước (yếu tố nồng độ trong cân bằng phản ứng hoá học). Dĩ nhiên dung dịch NaCl cũng sẽ không hấp thu hết khí HCl, phần khí HCl còn lại sẽ được hấp thu tiếp ở bình 2, và cuối cùng sẽ giữ lại ở bông tẩm dung dịch NaOH.
(rất nhiều em sẽ chọn đáp án B – về lý thuyết thì thuyết phục hơn đáp án A: bình 1 đựng dung dịch H₂SO₄ đặc để hấp thu hết hơi nước (H₂SO₄ đặc rất háo nước), khí HCl tiếp tục đi qua được hấp thu ở bình 2 đựng dung dịch NaCl. Thực tế đáp án B không được chọn vì khi khí HCl đi vào H₂SO₄ đặc, nó tan rất mạnh, tỏa nhiều nhiệt => gây nóng cục bộ, nguy cơ vỡ bình thí nghiệm – yếu tố nguy hiểm trong PTN và khi nhiệt tạo ra làm nóng dung dịch acid thì một phần HCl bay hơi trở lại (=> hấp thu khí HCl không hiệu quả). Loại đáp án C: Chlorine tác dụng với dung dịch AgNO₃ (tạo AgCl kết tủa); Loại đáp án D: Chlorine tác dụng với dung dịch NaOH (tạo NaCl, NaClO))